Формула кислорода. Периодическая таблица Менделеева - кислород. В2О что это
О2О маркетинг или ecommerce эволюция по-китайски
Ежегодный онлайн-шопинг фестиваль от Alibaba, который прошел 11 ноября, менее чем за сутки выручил $14,3 млрд. Это в четыре раза больше, чем прибыль американского Киберпонедельника. Однако процесс развития сферы маркетинга в Китае не стоит на месте, и обычной электронной коммерции специалистам отрасли в этой стране уже недостаточно. Они открывают для себя новые перспективы в многоканальной розничной торговле, известной в Китае как «O2O», что означает «онлайн в оффлайн». Цель стратегии – привлечь интернет пользователей в оффлайн-магазины.

«Всякий раз, когда Alibaba устанавливает новый приоритет для Китая, крупнейшего в мире рынка интернет-коммерции, бренды моментально включаются в работу и дело приобретает колоссальный оборот», – прокомментировал Alex Misseri, старший вице-президент розничной торговли и коммерции в Razorfish Asia-Pacific.
Так, например, во время посещения одиного из 180 000 магазинов-партнеров, мобильное приложение от Alibaba предлагало покупателю просканировать специальный код, чтобы поучаствовать в розыгрыше купонов к распродаже 11.11. Разыгрывались купоны на общую сумму $755 млн.
«Еще один прорыв – доставлять заказы из ближайших магазинов, а не с удаленных складов. Благодаря чему время доставки значительно сокращается, и сможет измеряться минутами, а не часами и днями», – добавил Alex Misseri.
Розничные продавцы, у которых есть свои магазины на платформе Tmall от Alibaba, также заинтересованы в развитии направления O2O. Например, Cadillac продают свои автомобили онлайн посредством Tmall, при этом первые 100 покупателей, принявшие участие в акции 11.11, получили ATS-L за полцены. Проект O2O предлагал еще один небольшой бонус: покупатели, посетившие шоу-рум и опубликовавшие фото автомобиля в приложении WeChat, получали дополнительную скидку в $31.
Однако не только в Alibaba сделали ставку на стратегию O2O; другие китайские гиганты, Tencent и Baidu, также борются за первенство в этом сегменте. Robin Li, генеральный директор Baidu, третьей в мире цифровой рекламной платформы после Google and Facebook, даже назвал O2O будущим компании. Сегодня она специализируется в основном на поисковом маркетинге. При этом он выразил сожаление, что западные инвесторы еще не оценили все возможности новой стратегии.
Жесткая конкуренция между китайскими гигантами и их затраты на проекты O2O стали толчком к расцвету мобильных технологий в Китае.
WeChat от Tencent теперь не просто приложение для общения; с помощью него можно купить билеты на самолет, вызвать такси, оплатить счета, сыграть в спонсированную мобильную игру или сделать покупки. (Чтобы убедить пользователей привязать свои банковские карты к WeChat, накануне Китайского Нового года компания запустила ряд популярных социальных игр, вдохновленных традицией дарить в этот день деньги в красных конвертах).
Tencent сотрудничает со вторым крупнейшим в Китае онлайн-ритейлером – JD.com, который, как и Alibaba, организует собственные распродажи 11 ноября. Эта компания владеет платформой онлайн-отзывов и популярным сервисом Dianping, интегрированным с WeChat. С его помощью всего за пару кликов можно заказать обед у повара ($15.50), вызвать на дом мастера маникюра (от $10.70) или попросить кого-нибудь помыть вашу машину ($6.13).
«Создание подобного сервиса стало возможным благодаря низкой стоимости труда в Китае и высокой плотности населения в мегаполисах», – считает Eugene Chew, директор по цифровым технологиям в J. Walter Thompson Shanghai. Люди также находят подобные услуги удобными, так как владельцев личных автомобилей в Китае достаточно мало и не во всех городах широко распространена розничная торговля. Еще один фактор – Китай осваивает новые технологии невероятно быстро.
«Многие перескочили поколение ПК и сразу начали активно использовать смартфоны, поэтому они очень легко осваивают любые нововведения», – добавил Eugene Chew. Уровень жизни в Китае растет вместе с покупательской способностью, поэтому люди готовы открывать для себя новинки и покупать новые вещи, при этом они открыты для маркетинга.
Как бренды и агентства работают со стратегией O2O
Возможности O2O маркетинга могут показаться довольно ограниченными: сколько способов получения мобильных купонов в магазинах можно придумать? Но вот креативные примеры нескольких последних кампаний, в которых агентства проявили фантазию, объединяя онлайн и оффлайн миры.
ECCOБренд представил мобильную игру и видео известного travel блогера, испытывающего на прочность свой новый непромокаемый ботинок. Кампания от Wunderman and Agenda привлекла в магазины 34 000 людей, желающих протестировать обувь на прочность и водостойкость. Для этого нужно было пройтись в ней в специальном устройстве в течение трех минут. За время кампании продажи выросли более чем в три раза.
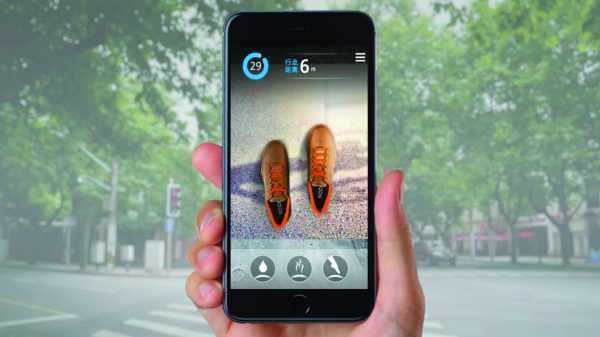
В рамках кампания Olay в честь Дня матери от местного агентства Social Touch в WeChat был запущен онлайн-вопросник, помогающий женщинам определить свой тип кожи. Также им предложили купон на поездку в такси от сервиса Didi Kuaidi, чтобы провести дополнительный тест уже в магазине. Также в этот день всем пассажиркам такси, высадившимся недалеко от торгового центра, где продавалась продукция Olay, раздавали купоны.
На изготовление продукции от Nike по индивидуальному заказу обычно уходит несколько недель. Чтобы скрасить ожидание покупателей, Razorfish помогли Nike разработать анимацию, показывающую процесс создания дизайна. При этом ей можно поделиться в WeChat и добавить кнопку «купить».

rusability.ru
h3O- это вода. а O2- это........
sviaz takaja,sam polzujus
Да вроде кислород
Молекулярный кислород (который в воздухе)
О - атом кислорода (можно употреблять так же в случая типа: "О, точно... ", "О.. давно бы так...." и др.) или<br>О1 - в принципе атом кислорода но так не пишут (пожарная. горение процесс окисления с выделением тепла и света обычно в среде кислорода т.е О2. Кода пожарные приезджают милиция тоже тут как тут и скорая тоже, а бывает и служба газа) <br>О2 - кислород (или милиция в зависимости от ситуации)<br>О3 - озон (или скорая помощь, тож в зависимости от ситуации) кстати неустойчивое вещество при распаде образуется О2 и О, О в свою очередь соединяется с другим свободным О и тогда получается О2, О как бывает...<br>О4 - такого соединения нету (но служба такая есть - служба газа)<br>В общем без О жизни небыло как не крути.<br>О... как прикольно в мире бывает ;))
всё зависит от того,как написано:<br>С одной стороны 02 - это правоохранительные органы,а точнее милиция,<br>а с другой стороны это химическая формула атома кислорода(О2),по новой номенклатуре - оксиген
О2 он и в африке О2
O2 - это кислород. <br>а O4 существует, но не везде и не очень долго.
Это когда открываешь проверенную контрольную работу, а там - 2! И ты<br>говоришь - О! 2!
О2- Это кислород
аш-два-о - девиз не наш! наш - це-два-аш-пять-о-аш!
ДА вроде кислород
кислород ppm миллионая доля
touch.otvet.mail.ru
ВОДА, h3O - это... Что такое ВОДА, h3O?
h3O: Просто добавь воды — h3O: Just Add Water … Википедия
Вода — ВОДА, h3O, жидкость без запаха, вкуса и цвета; плотность 1,000 г/см3 (3,98°C), tпл 0°C, tкип 100°C; при замерзании образует лед. Одно из наиболее распространенных соединений в природе (количество воды на поверхности Земли 1,39´1018 т, в атмосфере … Иллюстрированный энциклопедический словарь
вода — вода, h3O, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая). Простейшее устойчивое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Плотность 1000 г/см3 (3,98ºC), tпл 0ºС, tкип 100ºC. Самое распространённое вещество … Сельское хозяйство. Большой энциклопедический словарь
h3O: Просто добавь воды. Список серий телесериала — Содержание 1 Эпизоды 2 Обзор сезонов 3 Список серий 3.1 … Википедия
Вода — хим. соединение водорода и кислорода. Весовой состав ее: 11,19% Н и 88,81% О. Молекулярная масса 18,0153. В молекуле В. имеется 10 электронов (5 пар): одна пара внутренних электронов расположена вблизи ядра кислорода, две пары внешних электронов… … Геологическая энциклопедия
ВОДА — вода, окись водорода, h3O, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Молекулярная масса 18,0160, t замерзания 0°C (при 1 ат), t кипения 100ºC (при 1 ат), плотность при… … Ветеринарный энциклопедический словарь
вода (вещество) — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN water (substance) Common liquid (h3O) which forms rain, rivers, the sea, etc., and which makes up a large part of the bodies of organisms. (Source: PHC)… … Справочник технического переводчика
вода адсорбційна — вода адсорбционная adsorbtion water Adsorptionswasser молекули h3O, які притягаються мінералами під впливом поверхневої енергії … Гірничий енциклопедичний словник
ВОДА — h3O, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая). Простейшее устойчивое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Плота. 1000 г/см3 (3,98 °С), tпл 0 °С, tкип 100 °С. Самое распространённое в во в природе … Сельско-хозяйственный энциклопедический словарь
Вода — окись водорода, h30, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% водорода и 88,81% кислорода по массе), молекулярная масса 18,0160; бесцветная жидкость без запаха и вкуса (в толстых слоях… … Большая советская энциклопедия
dic.academic.ru
Что означают записи 3H, 2h3O, 5O2 и какую информацию получают с их помощью
Тем, кто только начинает знакомиться с химией и присущими ей видами обозначения различных веществ и уравнений, необходимо знать определенные правила, применяемые в международной практике. Следующие примеры помогут разобраться, что означают записи 3H, 2h3O, 5O2 и какую информацию получают из данного набора цифр и букв.
Числа в выражениях и их возможные виды
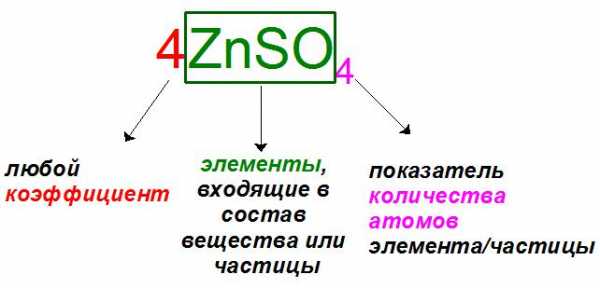
Если читать выражения слева направо, то первыми всегда записываются так называемые коэффициенты. Эти показатели характеризуют количество частиц или вещества (атомов, молекул, ионов, моль), участвующих в реакции. Коэффициенты принято записывать арабскими цифрами: обычно это все положительные натуральные числа (1, 2, 3…), если только речь не идет об эквивалентах, где они могут записываться как дробные (1/2, 1/3, 1/4…).
Например, цифры в записях 3H, 2h3O и 5O2 в химии означают, что нам даны 3 атома водорода H, 2 и 5 молекул воды h3O и газообразного кислорода O2 соответственно. Следует обратить внимание, что первый пример является неверным, так как атомарный H в природе не существует, а присутствует только в виде молекулы h3 или же в растворе в качестве положительно заряженного иона H+.
Если в уравнении частица или вещество участвует в единственном числе, например ион хлора 1Cl- или молекула серной кислоты 1h3SO4, коэффициент «1» опускают и записывают без него: Cl- и h3SO4.
В случае записи уравнений в общем виде, характерном для реакции полимеризации, поликонденсации, электролиза и других химических взаимодействий, в условиях задачи могут использовать буквенные обозначения количества частиц или веществ, вроде n или x, y, z . Коэффициент n обычно обозначает любое натуральное число, он обязательно должен присутствовать в обеих частях уравнения (пример 1), а любые другие буквы английского алфавита обозначают неизвестные, которые необходимо найти по условию задачи (пример 2).
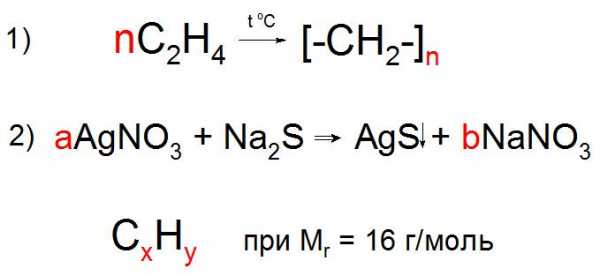
Буквенные выражения и их информативность
Символы английского алфавита в записях 3H, 2h3O и 5O2 означают, что в веществах содержатся определенные химические элементы, а также их соединения. Такую запись без цифр спереди называют химической формулой. Так, записи 3H+, 2h3O и 5O2 означают, что, допустим, в реакции участвуют 3 иона водорода, 2 и 5 молекул воды и кислорода соответственно. Но такого рода выражения также могут быть указаны в тексте и в обособленном от уравнений виде в качестве описания реагентов или продуктов реакции.
Подстрочные символы и их обозначения
В состав веществ может входить множество атомов отдельно взятых элементов, а также сами соединения иметь повторяющиеся звенья в зависимости от их природы и структуры. Для указания количества тех или иных частиц используются подстрочные цифры или буквы, имеющие тот же характер обозначения, что и основные коэффициенты. Например, нижние числа в записях 3H+, 2h3O и 5O2 означают, что подобные символы могут быть только в комплексных ионах типа [Cu(Nh4)4]2+, а в молекулах таких веществ, как вода и кислород, содержатся по 2 атома водорода и кислорода.
Буквы применяют в подстрочных символах в качестве обозначений некоторого количества атомов или звеньев (n), а также неизвестного количества атомов в соединениях при составлении задач (a, b, x, y).
fb.ru
Формула кислорода. Периодическая таблица Менделеева
Химический элемент кислород находится во втором периоде VI-ой главной группы устаревшего короткого варианта периодической таблицы. По новым стандартам нумерации — это 16-я группа. Соответствующее решение принято ИЮПАК в 1988 году. Формула кислорода как простого вещества — О2. Рассмотрим его основные свойства, роль в природе и хозяйстве. Начнем с характеристики всей группы периодической системы, которую возглавляет кислород. Элемент отличается от родственных ему халькогенов, а вода отличается от водородных соединений серы, селена и теллура. Объяснение всем отличительным чертам можно найти, только узнав о строении и свойствах атома.
Халькогены — родственные кислороду элементы
Сходные по свойствам атомы образуют одну группу в периодической системе. Кислород возглавляет семейство халькогенов, но отличается от них по ряду свойств.
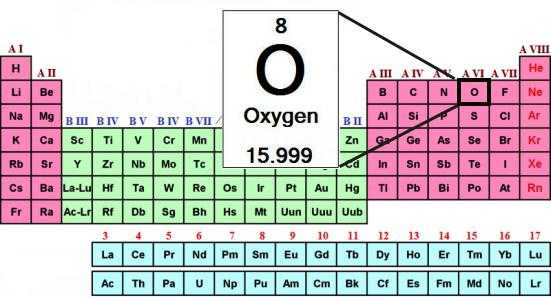
Атомная масса кислорода — родоначальника группы — составляет 16 а. е. м. Халькогены при образовании соединений с водородом и металлами проявляют свою обычную степень окисления: –2. Например, в составе воды (Н2О) окислительное число кислорода равно –2.
Состав типичных водородных соединений халькогенов отвечает общей формуле: Н2R. При растворении этих веществ образуются кислоты. Только водородное соединение кислорода — вода — обладает особыми свойствами. Согласно выводам ученых, это необычное вещество является и очень слабой кислотой, и очень слабым основанием.
Сера, селен и теллур имеют типичные положительные степени окисления (+4, +6) в соединениях с кислородом и другими неметаллами, обладающими высокой электроотрицательностью (ЭО). Состав оксидов халькогенов отражают общие формулы: RO2, RO3. Соответствующие им кислоты имеют состав: h3RO3, h3RO4.
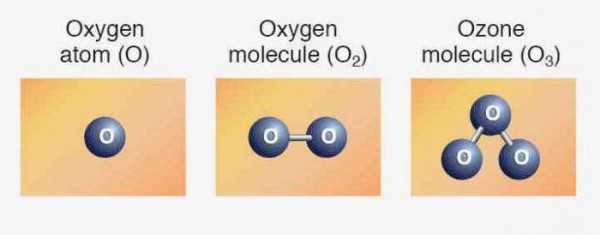
Элементам соответствуют простые вещества: кислород, сера, селен, теллур и полоний. Первые три представителя проявляют неметаллические свойства. Формула кислорода — О2. Аллотропное видоизменение того же элемента - озон (О3). Обе модификации являются газами. Сера и селен — твердые неметаллы. Теллур — металлоидное вещество, проводник электрического тока, полоний — металл.
Кислород — самый распространенный элемент
Общее содержание атомов элемента в земной коре составляет примерно 47 % (по весу). Кислород встречается как в свободном виде, так и в составе многочисленных соединений. Простое вещество, формула которого О2, находится в составе атмосферы, составляя 21 % воздуха (по объему). Молекулярный кислород растворен в воде, находится между частичками почвы.
Мы уже знаем, что есть другая разновидность существования того же самого химического элемента в форме простого вещества. Это озон — газ, образующий на высоте около 30 км от поверхности земли слой, часто называемый озоновым экраном. Связанный кислород входит в молекулы воды, в состав многих горных пород и минералов, органических соединений.
Строение атома кислорода
Периодическая таблица Менделеева содержит полную информацию о кислороде:
- Порядковый номер элемента — 8.
- Заряд ядра — +8.
- Общее число электронов — 8.
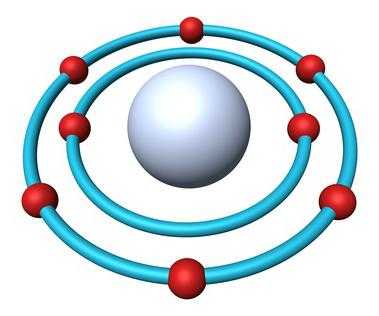
- Электронная формула кислорода — 1s22s22p4.
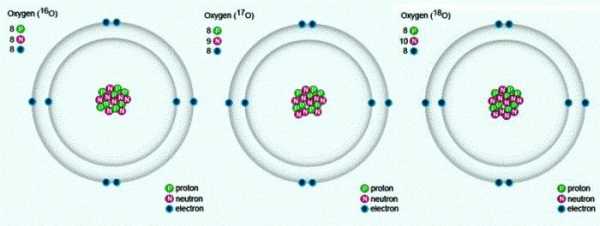
В природе встречаются три стабильных изотопа, которые имеют одинаковый порядковый номер в таблице Менделеева, идентичный состав протонов и электронов, но разное число нейтронов. Обозначаются изотопы одним и тем же символом — О. Для сравнения приведем схему, отражающую состав трех изотопов кислорода:
Свойства кислорода — химического элемента
На 2р-подуровне атома имеются два неспаренных электрона, что объясняет появление степеней окисления –2 и +2. Два спаренных электрона не могут разъединиться, чтобы степень окисления возросла до +4, как у серы и других халькогенов. Причина — отсутствие свободного подуровня. Поэтому в соединениях химический элемент кислород не проявляет валентность и степень окисления, равные номеру группы в коротком варианте периодической системы (6). Обычное для него окислительное число равно –2.
Только в соединениях с фтором кислород проявляет нехарактерную для него положительную степень окисления +2. Значение ЭО двух сильных неметаллов отличается: ЭО (О) = 3,5; ЭО (F) = 4. Как более электроотрицательный химический элемент, фтор сильнее удерживает свои электроны и притягивает валентные частицы на внешнем энергетическом уровне атома кислорода. Поэтому в реакции с фтором кислород является восстановителем, отдает электроны.
Кислород — простое вещество
Английский исследователь Д. Пристли в 1774 году в ходе опытов выделил газ при разложении оксида ртути. Двумя годами ранее это же вещество в чистом виде получил К. Шееле. Лишь спустя несколько лет французский химик А. Лавуазье установил, что за газ входит в состав воздуха, изучил свойства. Химическая формула кислорода — О2. Отразим в записи состава вещества электроны, участвующие в образовании неполярной ковалентной связи — О::О. Заменим каждую связывающую электронную пару одной чертой: О=О. Такая формула кислорода наглядно показывает, что атомы в молекуле связаны между двумя общими парами электронов.

Выполним несложные расчеты и определим, чему равна относительная молекулярная масса кислорода: Mr(O2) = Ar(O) х 2 = 16 х 2 = 32. Для сравнения: Mr(возд.) = 29. Химическая формула кислорода отличается от формулы озона на один атом кислорода. Значит, Mr(O3) = Ar(O) х 3 = 48. Озон в 1,5 раза тяжелее кислорода.
Физические свойства
Кислород — это газ без цвета, вкуса и запаха (при обычной температуре и давлении, равном атмосферному). Вещество немного тяжелее воздуха; растворяется в воде, но в небольших количествах. Температура плавления кислорода является отрицательной величиной и составляет –218,3 °C. Точка, в которой жидкий кислород вновь превращается в газообразный, — это его температура кипения. Для молекул О2 значение этой физической величины достигает –182,96 °C. В жидком и твердом состоянии кислород приобретает светло-синюю окраску.
Получение кислорода в лаборатории
При нагревании кислородосодержащих веществ, например перманганата калия, выделяется бесцветный газ, который можно собрать в колбу или пробирку. Если внести в чистый кислород зажженную лучину, то она горит более ярко, чем в воздухе. Два других лабораторных способа получения кислорода - разложение пероксида водорода и хлората калия (бертолетовой соли). Рассмотрим схему прибора, который применяется для термического разложения.
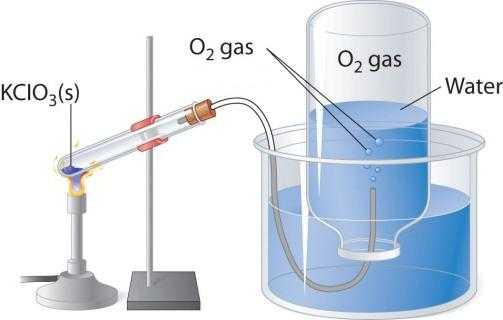
В пробирку или круглодонную колбу надо насыпать немного бертолетовой соли, закрыть пробкой с газоотводной трубочкой. Ее противоположный конец следует направить (под водой) в опрокинутую вверх дном колбу. Горлышко должно быть опущено в широкий стакан или кристаллизатор, наполненный водой. При нагревании пробирки с бертолетовой солью выделяется кислород. По газоотводной трубке он поступает в колбу, вытесняя из нее воду. Когда колба наполнится газом, ее закрывают под водой пробкой и переворачивают. Полученный в этом лабораторном опыте кислород можно использовать для изучения химических свойств простого вещества.
Горение
Если в лаборатории проводится сжигание веществ в кислороде, то нужно знать и соблюдать противопожарные правила. Водород мгновенно сгорает в воздухе, а смешанный с кислородом в соотношении 2:1, он взрывоопасен. Горение веществ в чистом кислороде происходит намного интенсивнее, чем в воздухе. Объясняется это явление составом воздуха. Кислород в атмосфере составляет чуть больше 1/5 части (21%). Горение — это реакция веществ с кислородом, в результате которой образуются разные продукты, в основном оксиды металлов и неметаллов. Пожароопасны смеси О2 с горючими веществами, кроме того, получившиеся соединения могут быть токсичными.
Горение обычной свечки (или спички) сопровождается образованием диоксида углерода. Следующий опыт можно провести в домашних условиях. Если сжигать вещество под стеклянной банкой или большим стаканом, то горение прекратится, как только израсходуется весь кислород. Азот не поддерживает дыхание и горение. Углекислый газ — продукт окисления — больше не вступает в реакцию с кислородом. Прозрачная известковая вода позволяет обнаружить присутствие диоксида углерода после горения свечи. Если пропускать продукты горения через гидроксид кальция, то раствор мутнеет. Происходит химическая реакция между известковой водой и углекислым газом, получается нерастворимый карбонат кальция.

Получение кислорода в промышленных масштабах
Самый дешевый процесс, в результате которого получаются свободные от воздуха молекулы О2, не связан с проведением химических реакций. В промышленности, скажем, на металлургических комбинатах, воздух при низкой температуре и высоком давлении сжижают. Такие важнейшие компоненты атмосферы, как азот и кислород, кипят при разных температурах. Разделяют воздушную смесь при постепенном нагревании до обычной температуры. Сначала выделяются молекулы азота, затем кислорода. Способ разделения основан на разных физических свойствах простых веществ. Формула простого вещества кислорода такая же, как была до охлаждения и сжижения воздуха, — О2.
В результате некоторых реакций электролиза тоже выделяется кислород, его собирают над соответствующим электродом. Газ нужен промышленным, строительным предприятиям в больших объемах. Потребности в кислороде постоянно растут, особенно нуждается в нем химическая промышленность. Хранят полученный газ для производственных и медицинских целей в стальных баллонах, снабженных маркировкой. Емкости с кислородом окрашивают в синий или голубой цвет, чтобы отличать от других сжиженных газов — азота, метана, аммиака.

Химические расчеты по формуле и уравнениям реакций с участием молекул О2
Численное значение молярной массы кислорода совпадает с другой величиной — относительной молекулярной массой. Только в первом случае присутствуют единицы измерения. Коротко формула вещества кислорода и его молярной массы должна быть записана так: М(О2) = 32 г/моль. При нормальных условиях молю любого газа соответствует объем 22,4 л. Значит, 1 моль О2 — это 22,4 л вещества, 2 моль О2 — 44,8 л. По уравнению реакции между кислородом и водородом можно заметить, что взаимодействуют 2 моля водорода и 1 моль кислорода:
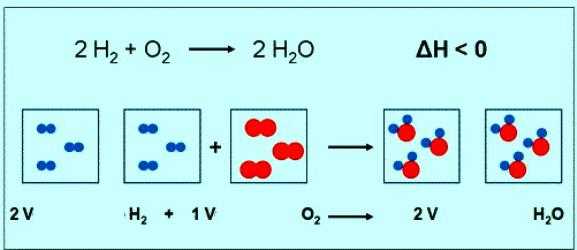
Если в реакции участвует 1 моль водорода, то объем кислорода составит 0,5 моль • 22,4 л/моль = 11,2 л.
Роль молекул О2 в природе и жизни человека
Кислород потребляется живыми организмами на Земле и участвует в круговороте веществ свыше 3 млрд лет. Это главное вещество для дыхания и метаболизма, с его помощью происходит разложение молекул питательных веществ, синтезируется необходимая для организмов энергия. Кислород постоянно расходуется на Земле, но его запасы пополняются благодаря фотосинтезу. Русский ученый К. Тимирязев считал, что благодаря именно этому процессу до сих пор существует жизнь на нашей планете.

Велика роль кислорода в природе и хозяйстве:
- поглощается в процессе дыхания живыми организмами;
- участвует в реакциях фотосинтеза в растениях;
- входит в состав органических молекул;
- процессы гниения, брожения, ржавления протекают при участии кислорода, выступающего в качестве окислителя;
- используется для получения ценных продуктов органического синтеза.
Сжиженный кислород в баллонах используют для резки и сварки металлов при высоких температурах. Эти процессы проводят на машиностроительных заводах, на транспортных и строительных предприятиях. Для проведения работ под водой, под землей, на большой высоте в безвоздушном пространстве люди тоже нуждаются в молекулах О2. Кислородные подушки применяются в медицине для обогащения состава воздуха, вдыхаемого больными людьми. Газ для медицинских целей отличается от технического практически полным отсутствием посторонних примесей, запаха.

Кислород — идеальный окислитель
Известны соединения кислорода со всеми химическими элементами таблицы Менделеева, кроме первых представителей семейства благородных газов. Многие вещества непосредственно вступают в реакции с атомами О, исключая галогены, золото и платину. Большое значение имеют явления с участием кислорода, которые сопровождаются выделением света и тепла. Такие процессы широко используются в быту, промышленности. В металлургии взаимодействие руд с кислородом называют обжигом. Предварительно измельченную руду смешивают с воздухом, обогащенным кислородом. При высоких температурах происходит восстановление металлов из сульфидов до простых веществ. Так получают железо и некоторые цветные металлы. Присутствие чистого кислорода повышает скорость технологических процессов в разных отраслях химии, технике и металлургии.
Появление дешевого способа получения кислорода из воздуха методом разделения на компоненты при низкой температуре стимулировало развитие многих направлений промышленного производства. Химики считают молекулы О2 и атомы О идеальными окислительными агентами. Это естественные материалы, они постоянно возобновляются в природе, не загрязняют окружающую среду. Кроме того, химические реакции с участием кислорода чаще всего завершаются синтезом еще одного натурального и безопасного продукта — воды. Велика роль О2 в обезвреживании токсичных производственных отходов, очистке воды от загрязнений. Кроме кислорода, для обеззараживания используется его аллотропная модификация — озон. Это простое вещество обладает высокой окислительной активностью. При озонировании воды разлагаются загрязняющие вещества. Озон также губительно действует на болезнетворную микрофлору.
fb.ru
Оксид калия: формула, взаимодействие :: SYL.ru
В неорганической химии существует три основных класса соединений. Это кислоты, щелочи и оксиды. Кислота состоит из катиона водорода и аниона кислотного остатка. Щелочь - из катиона металла и гидроксильной группы. Об оксидах мы поговорим подробнее далее.
Что такое оксид?
Это соединение, состоящее из двух разных химических элементов, одним из которых является кислород. Вторым же может быть металл или неметалл. Количество атомов кислорода зависит от валентности второго химического элемента, входящего в состав соединения. Так, например, валентность калия равна одному, поэтому оксид калия будет содержать один атом кислорода и два атома калия. Валентность кальция равна двум, поэтому его оксид будет состоять из одного атома кислорода и одного атома кальция. Валентность фосфора равна пяти, поэтому его оксид состоит из двух атомов фосфора и пяти атомов кислорода.
В этой статье мы более подробно поговорим про оксид калия. А именно - о его физических и химических свойствах, о его применении в различных областях промышленности.
Оксид калия: формула
Так как валентность данного металла равна одному, а валентность кислорода - двум, то это химическое соединение будет состоять из двух атомов металла и одного атома Оксигена. Итак, оксид калия: формула - К2О.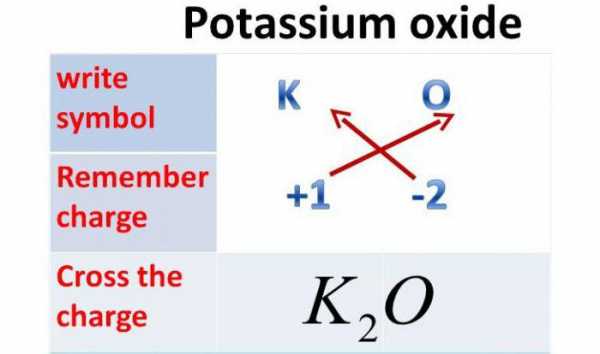
Физические свойства
Рассматриваемый оксид обладает бледно-желтой окраской. Иногда он может быть и бесцветным. При комнатной температуре он обладает твердым агрегатным состоянием.
Температура плавления данного вещества равняется 740 градусам Цельсия.
Плотность составляет 2,32 г/см3.
При термическом разложении данного оксида образуется пероксид этого же металла и чистый калий.
Растворим в органических растворителях.
В воде не растворяется, а вступает в реакцию с ней.
Обладает высокой гигроскопичностью.
Химические свойства К2О
Данное вещество обладает типичными для всех основных оксидов химическими свойствами. Рассмотрим химические реакции данного оксида с различными веществами по порядку.
Реакция с водой
В первую очередь оно способно реагировать с водой с образованием в результате гидроксида данного металла.
Уравнение такой реакции выглядит следующим образом:
Зная молярную массу каждого из веществ, из уравнения можно сделать следующий вывод: из 94 граммов рассматриваемого оксида и 18 граммов воды можно получить 112 граммов калий гидроксида.
С другими оксидами
Кроме того, рассматриваемый оксид способен реагировать с диоксидом карбона (углекислым газом). При этом образуется соль - карбонат калия.
Уравнение реакции оксида калия и оксида карбона можно записать следующим образом:
Так, можно сделать вывод, что из 94 граммов рассматриваемого оксида и 44 граммов углекислого газа получается 138 граммов калий карбоната.
Также рассматриваемый оксид может вступать в реакцию с оксидом сульфура. При этом образуется другая соль - калий сульфат.
Взаимодействие оксида калия с оксидом сульфура можно выразить следующим уравнением:
Из него видно, что, взяв 94 грамма рассматриваемого оксида и 80 граммов оксида сульфура, можно получить 174 грамма сульфата калия.
Таким же образом К2О может реагировать и с другими оксидами.
Другой тип взаимодействия - реакции не с кислотными, а с амфотерными оксидами. В таком случае образуется не кислота, а соль. Примером такого химического процесса может служить взаимодействие рассматриваемого оксида с оксидом цинка.
Эту реакцию можно выразить следующим уравнением:
Из него видно, что при взаимодействии рассматриваемого оксида и оксида цинка образуется соль под названием калий цинкат. Если знать молярную массу всех веществ, то можно подсчитать, что из 94 граммов К2О и 81 грамма оксида цинка можно получить 175 граммов калий цинката.
Также К2О способен взаимодействовать с оксидом азота. При этом образуется смесь из двух солей: нитрата и нитрита калия. Уравнение этой реакции выглядит таким образом:
- К2О + 2NO2 = KNO3 + KNO2
Если знать молярные массы веществ, можно сказать, что из 94 граммов рассматриваемого оксида и 92 граммов оксида нитрогена можно получить 101 грамм нитрата и 85 граммов нитрита.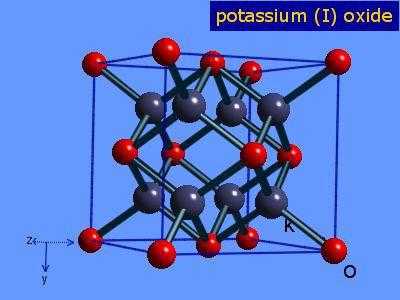
Взаимодействие с кислотами
Самый распространенный случай - оксид калия + серная кислота = сульфат калия + вода. Уравнение реакции выглядит таким образом:
- К2О + h3SO4 = K2SO4 + Н2О
Из уравнения можно сделать вывод, что для получения 174 граммов сульфата калия и 18 граммов воды необходимо взять 94 грамма рассматриваемого оксида и 98 граммов серной кислоты.
Похожим образом происходит химическое взаимодействие между рассматриваемым оксидом и азотной кислотой. При этом образуется нитрат калия и вода. Уравнение этой реакции можно записать следующим образом:
- 2К2О + 4HNO3 = 4KNO3 + 2Н2О
Таким образом, из 188 граммов рассматриваемого оксида и 252 граммов азотной кислоты можно получить 404 грамма нитрата калия и 36 граммов воды.
По такому же принципу рассматриваемый оксид может реагировать и с другими кислотами. В процессе этого будут образовываться другие соли и вода. Так, к примеру, при реакции этого оксида с фосфорной кислотой получается фосфат и вода, с хлоридной кислотой - хлорид и вода и так далее.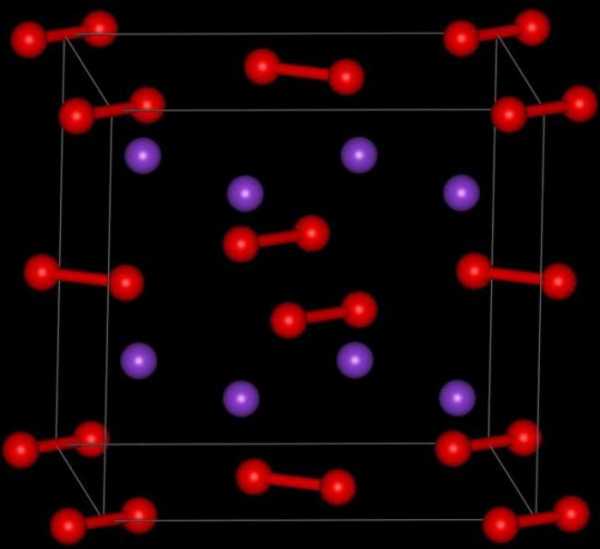
К2О и галогены
Рассматриваемое химическое соединение способно реагировать и с веществами данной группы. К галогенам относятся простые соединения, состоящие из нескольких атомов одного и того же химического элемента. Это, например, хлор, бром, иод и некоторые другие.
Итак, хлор и оксид калия: уравнение:
- К2О + СІ2 = КСІ + КСІО
В результате такого взаимодействия образуется две соли: хлорид и гипохлорит калия. Из 94 грамм рассматриваемого оксида и 70 грамм хлора получается 74 грамма хлорида калия и 90 грамм гипохлорита калия.
Взаимодействие с аммиаком
К2О способен реагировать с этим веществом. В результате такого химического взаимодействия образуется гидроксид и амид калия. Уравнение данной реакции выглядит следующим образом:
- К2О + Nh4 = КОН + KNh3
Зная молярные массы всех веществ, можно вычислить пропорции реагентов и продуктов реакции. Из 94 граммов рассматриваемого оксида и 17 граммов аммиака можно получить 56 граммов гидроксида калия и 55 граммов амида калия.
Взаимодействие с органическими веществами
Из органических химических веществ оксид калия взаимодействует с эфирами и спиртами. Однако эти реакции идут медленно и требуют специальных условий.
Получение К2О
Данное химическое вещество можно получать несолькими способами. Вот самые распространенные из них:
- Из нитрата калия и металлического калия. Эти два реагента нагревают, в результате чего образуется К2О и азот. Уравнение реакции выглядит следующим образом: 2KNO3 + 10К = N2 + 6К2О.
- Второй способ происходит в два этапа. Сначала происходит реакция между калием и кислородом, в результате чего образуется пероксид калия. Уравнение реакции выглядит так: 2К + О2 = К2О2. Далее пероксид обогащают калием, в результате чего и получают оксид калия. Уравнение реакции можно записать таким образом: К2О2 + 2К = 2К2О.

Использование К2О в промышленности
Наиболее часто рассматриваемое вещество используется в сельскохозяйственной промышленности. Данный оксид является одним из компонентов минеральных удобрений. Калий очень важен для растений, так как повышает их стойкость к различным заболеваниям. Также рассматриваемое вещество применяется в строительстве, так как может присутствовать в составе некоторых видов цемента. Кроме того, оно применяется в химической промышленности для получения других соединений калия.
www.syl.ru









