Формула кислорода. Периодическая таблица Менделеева - кислород. Что это о2
Формула кислорода. Периодическая таблица Менделеева
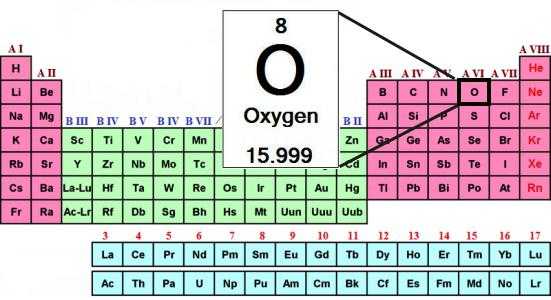
Химический элемент кислород находится во втором периоде VI-ой главной группы устаревшего короткого варианта периодической таблицы. По новым стандартам нумерации — это 16-я группа. Соответствующее решение принято ИЮПАК в 1988 году. Формула кислорода как простого вещества — О2. Рассмотрим его основные свойства, роль в природе и хозяйстве. Начнем с характеристики всей группы периодической системы, которую возглавляет кислород. Элемент отличается от родственных ему халькогенов, а вода отличается от водородных соединений серы, селена и теллура. Объяснение всем отличительным чертам можно найти, только узнав о строении и свойствах атома.
Халькогены — родственные кислороду элементы
Сходные по свойствам атомы образуют одну группу в периодической системе. Кислород возглавляет семейство халькогенов, но отличается от них по ряду свойств.
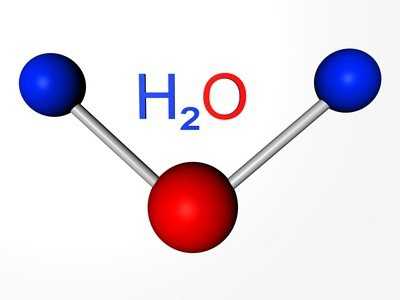
Атомная масса кислорода — родоначальника группы — составляет 16 а. е. м. Халькогены при образовании соединений с водородом и металлами проявляют свою обычную степень окисления: –2. Например, в составе воды (Н2О) окислительное число кислорода равно –2.
Состав типичных водородных соединений халькогенов отвечает общей формуле: Н2R. При растворении этих веществ образуются кислоты. Только водородное соединение кислорода — вода — обладает особыми свойствами. Согласно выводам ученых, это необычное вещество является и очень слабой кислотой, и очень слабым основанием.
Сера, селен и теллур имеют типичные положительные степени окисления (+4, +6) в соединениях с кислородом и другими неметаллами, обладающими высокой электроотрицательностью (ЭО). Состав оксидов халькогенов отражают общие формулы: RO2, RO3. Соответствующие им кислоты имеют состав: h3RO3, h3RO4.
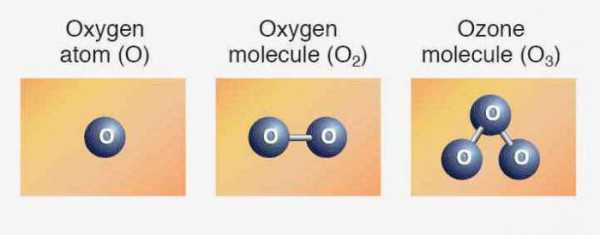
Элементам соответствуют простые вещества: кислород, сера, селен, теллур и полоний. Первые три представителя проявляют неметаллические свойства. Формула кислорода — О2. Аллотропное видоизменение того же элемента - озон (О3). Обе модификации являются газами. Сера и селен — твердые неметаллы. Теллур — металлоидное вещество, проводник электрического тока, полоний — металл.
Кислород — самый распространенный элемент
Общее содержание атомов элемента в земной коре составляет примерно 47 % (по весу). Кислород встречается как в свободном виде, так и в составе многочисленных соединений. Простое вещество, формула которого О2, находится в составе атмосферы, составляя 21 % воздуха (по объему). Молекулярный кислород растворен в воде, находится между частичками почвы.
Мы уже знаем, что есть другая разновидность существования того же самого химического элемента в форме простого вещества. Это озон — газ, образующий на высоте около 30 км от поверхности земли слой, часто называемый озоновым экраном. Связанный кислород входит в молекулы воды, в состав многих горных пород и минералов, органических соединений.
Строение атома кислорода
Периодическая таблица Менделеева содержит полную информацию о кислороде:
- Порядковый номер элемента — 8.
- Заряд ядра — +8.
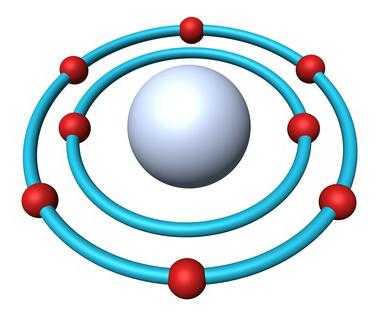
- Общее число электронов — 8.
- Электронная формула кислорода — 1s22s22p4.
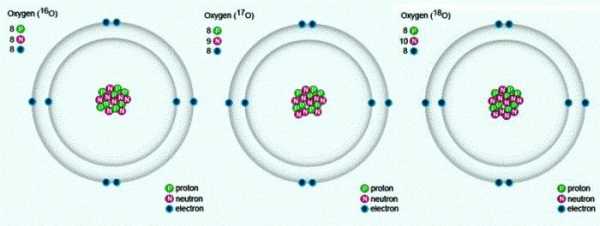
В природе встречаются три стабильных изотопа, которые имеют одинаковый порядковый номер в таблице Менделеева, идентичный состав протонов и электронов, но разное число нейтронов. Обозначаются изотопы одним и тем же символом — О. Для сравнения приведем схему, отражающую состав трех изотопов кислорода:
Свойства кислорода — химического элемента
На 2р-подуровне атома имеются два неспаренных электрона, что объясняет появление степеней окисления –2 и +2. Два спаренных электрона не могут разъединиться, чтобы степень окисления возросла до +4, как у серы и других халькогенов. Причина — отсутствие свободного подуровня. Поэтому в соединениях химический элемент кислород не проявляет валентность и степень окисления, равные номеру группы в коротком варианте периодической системы (6). Обычное для него окислительное число равно –2.
Только в соединениях с фтором кислород проявляет нехарактерную для него положительную степень окисления +2. Значение ЭО двух сильных неметаллов отличается: ЭО (О) = 3,5; ЭО (F) = 4. Как более электроотрицательный химический элемент, фтор сильнее удерживает свои электроны и притягивает валентные частицы на внешнем энергетическом уровне атома кислорода. Поэтому в реакции с фтором кислород является восстановителем, отдает электроны.
Кислород — простое вещество
Английский исследователь Д. Пристли в 1774 году в ходе опытов выделил газ при разложении оксида ртути. Двумя годами ранее это же вещество в чистом виде получил К. Шееле. Лишь спустя несколько лет французский химик А. Лавуазье установил, что за газ входит в состав воздуха, изучил свойства. Химическая формула кислорода — О2. Отразим в записи состава вещества электроны, участвующие в образовании неполярной ковалентной связи — О::О. Заменим каждую связывающую электронную пару одной чертой: О=О. Такая формула кислорода наглядно показывает, что атомы в молекуле связаны между двумя общими парами электронов.

Выполним несложные расчеты и определим, чему равна относительная молекулярная масса кислорода: Mr(O2) = Ar(O) х 2 = 16 х 2 = 32. Для сравнения: Mr(возд.) = 29. Химическая формула кислорода отличается от формулы озона на один атом кислорода. Значит, Mr(O3) = Ar(O) х 3 = 48. Озон в 1,5 раза тяжелее кислорода.
Физические свойства
Кислород — это газ без цвета, вкуса и запаха (при обычной температуре и давлении, равном атмосферному). Вещество немного тяжелее воздуха; растворяется в воде, но в небольших количествах. Температура плавления кислорода является отрицательной величиной и составляет –218,3 °C. Точка, в которой жидкий кислород вновь превращается в газообразный, — это его температура кипения. Для молекул О2 значение этой физической величины достигает –182,96 °C. В жидком и твердом состоянии кислород приобретает светло-синюю окраску.
Получение кислорода в лаборатории
При нагревании кислородосодержащих веществ, например перманганата калия, выделяется бесцветный газ, который можно собрать в колбу или пробирку. Если внести в чистый кислород зажженную лучину, то она горит более ярко, чем в воздухе. Два других лабораторных способа получения кислорода - разложение пероксида водорода и хлората калия (бертолетовой соли). Рассмотрим схему прибора, который применяется для термического разложения.
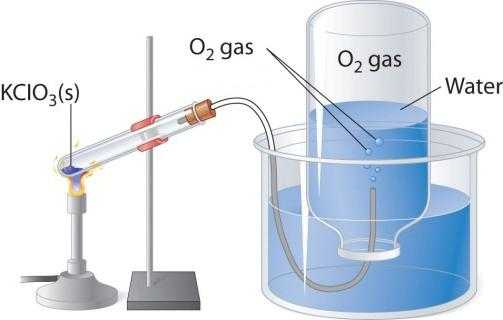
В пробирку или круглодонную колбу надо насыпать немного бертолетовой соли, закрыть пробкой с газоотводной трубочкой. Ее противоположный конец следует направить (под водой) в опрокинутую вверх дном колбу. Горлышко должно быть опущено в широкий стакан или кристаллизатор, наполненный водой. При нагревании пробирки с бертолетовой солью выделяется кислород. По газоотводной трубке он поступает в колбу, вытесняя из нее воду. Когда колба наполнится газом, ее закрывают под водой пробкой и переворачивают. Полученный в этом лабораторном опыте кислород можно использовать для изучения химических свойств простого вещества.
Горение
Если в лаборатории проводится сжигание веществ в кислороде, то нужно знать и соблюдать противопожарные правила. Водород мгновенно сгорает в воздухе, а смешанный с кислородом в соотношении 2:1, он взрывоопасен. Горение веществ в чистом кислороде происходит намного интенсивнее, чем в воздухе. Объясняется это явление составом воздуха. Кислород в атмосфере составляет чуть больше 1/5 части (21%). Горение — это реакция веществ с кислородом, в результате которой образуются разные продукты, в основном оксиды металлов и неметаллов. Пожароопасны смеси О2 с горючими веществами, кроме того, получившиеся соединения могут быть токсичными.
Горение обычной свечки (или спички) сопровождается образованием диоксида углерода. Следующий опыт можно провести в домашних условиях. Если сжигать вещество под стеклянной банкой или большим стаканом, то горение прекратится, как только израсходуется весь кислород. Азот не поддерживает дыхание и горение. Углекислый газ — продукт окисления — больше не вступает в реакцию с кислородом. Прозрачная известковая вода позволяет обнаружить присутствие диоксида углерода после горения свечи. Если пропускать продукты горения через гидроксид кальция, то раствор мутнеет. Происходит химическая реакция между известковой водой и углекислым газом, получается нерастворимый карбонат кальция.

Получение кислорода в промышленных масштабах
Самый дешевый процесс, в результате которого получаются свободные от воздуха молекулы О2, не связан с проведением химических реакций. В промышленности, скажем, на металлургических комбинатах, воздух при низкой температуре и высоком давлении сжижают. Такие важнейшие компоненты атмосферы, как азот и кислород, кипят при разных температурах. Разделяют воздушную смесь при постепенном нагревании до обычной температуры. Сначала выделяются молекулы азота, затем кислорода. Способ разделения основан на разных физических свойствах простых веществ. Формула простого вещества кислорода такая же, как была до охлаждения и сжижения воздуха, — О2.
В результате некоторых реакций электролиза тоже выделяется кислород, его собирают над соответствующим электродом. Газ нужен промышленным, строительным предприятиям в больших объемах. Потребности в кислороде постоянно растут, особенно нуждается в нем химическая промышленность. Хранят полученный газ для производственных и медицинских целей в стальных баллонах, снабженных маркировкой. Емкости с кислородом окрашивают в синий или голубой цвет, чтобы отличать от других сжиженных газов — азота, метана, аммиака.

Химические расчеты по формуле и уравнениям реакций с участием молекул О2
Численное значение молярной массы кислорода совпадает с другой величиной — относительной молекулярной массой. Только в первом случае присутствуют единицы измерения. Коротко формула вещества кислорода и его молярной массы должна быть записана так: М(О2) = 32 г/моль. При нормальных условиях молю любого газа соответствует объем 22,4 л. Значит, 1 моль О2 — это 22,4 л вещества, 2 моль О2 — 44,8 л. По уравнению реакции между кислородом и водородом можно заметить, что взаимодействуют 2 моля водорода и 1 моль кислорода:
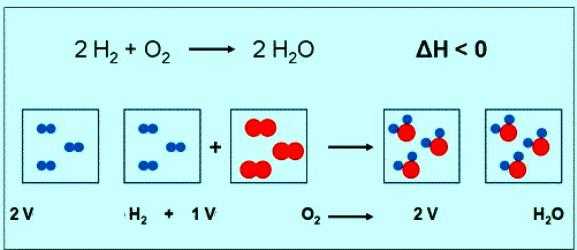
Если в реакции участвует 1 моль водорода, то объем кислорода составит 0,5 моль • 22,4 л/моль = 11,2 л.
Роль молекул О2 в природе и жизни человека
Кислород потребляется живыми организмами на Земле и участвует в круговороте веществ свыше 3 млрд лет. Это главное вещество для дыхания и метаболизма, с его помощью происходит разложение молекул питательных веществ, синтезируется необходимая для организмов энергия. Кислород постоянно расходуется на Земле, но его запасы пополняются благодаря фотосинтезу. Русский ученый К. Тимирязев считал, что благодаря именно этому процессу до сих пор существует жизнь на нашей планете.

Велика роль кислорода в природе и хозяйстве:
- поглощается в процессе дыхания живыми организмами;
- участвует в реакциях фотосинтеза в растениях;
- входит в состав органических молекул;
- процессы гниения, брожения, ржавления протекают при участии кислорода, выступающего в качестве окислителя;
- используется для получения ценных продуктов органического синтеза.
Сжиженный кислород в баллонах используют для резки и сварки металлов при высоких температурах. Эти процессы проводят на машиностроительных заводах, на транспортных и строительных предприятиях. Для проведения работ под водой, под землей, на большой высоте в безвоздушном пространстве люди тоже нуждаются в молекулах О2. Кислородные подушки применяются в медицине для обогащения состава воздуха, вдыхаемого больными людьми. Газ для медицинских целей отличается от технического практически полным отсутствием посторонних примесей, запаха.

Кислород — идеальный окислитель
Известны соединения кислорода со всеми химическими элементами таблицы Менделеева, кроме первых представителей семейства благородных газов. Многие вещества непосредственно вступают в реакции с атомами О, исключая галогены, золото и платину. Большое значение имеют явления с участием кислорода, которые сопровождаются выделением света и тепла. Такие процессы широко используются в быту, промышленности. В металлургии взаимодействие руд с кислородом называют обжигом. Предварительно измельченную руду смешивают с воздухом, обогащенным кислородом. При высоких температурах происходит восстановление металлов из сульфидов до простых веществ. Так получают железо и некоторые цветные металлы. Присутствие чистого кислорода повышает скорость технологических процессов в разных отраслях химии, технике и металлургии.
Появление дешевого способа получения кислорода из воздуха методом разделения на компоненты при низкой температуре стимулировало развитие многих направлений промышленного производства. Химики считают молекулы О2 и атомы О идеальными окислительными агентами. Это естественные материалы, они постоянно возобновляются в природе, не загрязняют окружающую среду. Кроме того, химические реакции с участием кислорода чаще всего завершаются синтезом еще одного натурального и безопасного продукта — воды. Велика роль О2 в обезвреживании токсичных производственных отходов, очистке воды от загрязнений. Кроме кислорода, для обеззараживания используется его аллотропная модификация — озон. Это простое вещество обладает высокой окислительной активностью. При озонировании воды разлагаются загрязняющие вещества. Озон также губительно действует на болезнетворную микрофлору.
Формула кислорода в химии
Определение и формула кислорода
Атомная масса: 15,9994 а.е.м.
Электронная формула: 1s2 2s2 2p4
Кислород – самый распространённый элемент в земной коре (47 % массы). Морские и пресные воды содержат 85,82 %(по массе) связанного кислорода. Содержание свободного кислорода в атмосфере составляет 20,95% по объёму и 23,10 % по массе. Кислород входит в состав молекул многих органических веществ. Число атомов кислорода в живых клетках составляет около 25 %, массовая доля кислорода в живых организмах – около 65 %.
Кислород существует в виде двухаллотропных модификаций – кислорода и озона.
Кислород (дикислород) – простое вещество, состоящее из двух атомов кислорода.
Формула: O2.
Структурная формула кислорода
Молярная масса: 31,998 г/моль.
Кислород при нормальных условиях – газ без цвета, вкуса и запаха. В жидком состоянии кислород светло-голубого цвета, а в твердом – светло-синие кристаллы.
Озон – простое вещество, состоящее из трех атомов кислорода.
Формула: O3.
Структурная формула:
Молярная масса: 47,998 г/моль
При нормальных условиях озон – сине-голубой газ с характерным резким запахом. В жидком состоянии – темно-фиолетового цвета (цвета индиго). В твердом виде – черные кристаллы с фиолетовым отблеском.
Озон присутствует в атмосфере, в так называемом озоновом слое, где он образуется из кислорода под действием ультрафиолетового излучения или грозовых разрядов:
Примеры решения задач
| Понравился сайт? Расскажи друзьям! | |||
ru.solverbook.com
кислород - это... Что такое кислород?
КИСЛОРО́Д -а; м. Химический элемент (O), газ без цвета и запаха, входящий в состав воздуха, необходимый для дыхания и горения и образующий в соединении с водородом воду.
◊ Перекрыть кислоро́д кому-л. Создать невыносимые условия жизни, работы.
◁ Кислоро́дный, -ая, -ое. К-ая среда. К-ые соединения. К-ая резка (газовая резка). К-ая сварка (газовая сварка). К-ое голодание; к-ая недостаточность (мед.; понижение содержания кислорода в тканях организма; гипоксия).
◊ Кислоро́дная подушка (см. Поду́шка).
КИСЛОРО́Д (лат. Oхygenium), O (читается «о»), химический элемент с атомным номером 8, атомная масса 15,9994. В периодической системе элементов Менделеева расположен во втором периоде в группе VIA. Природный кислород состоит из смеси трех стабильных нуклидов (см. НУКЛИД) с массовыми числами 16 (доминирует в смеси, его в ней 99,759 % по массе), 17 (0,037%) и 18 (0,204%). Радиус нейтрального атома кислорода 0,066 нм. Конфигурация внешнего электронного слоя нейтрального невозбужденного атома кислорода 2s2р4. Энергии последовательной ионизации атома кислорода 13,61819 и 35,118 эВ, сродство к электрону 1,467 эВ. Радиус иона О2-при разных координационных числах от 0,121 нм (координационное число 2) до 0,128 нм (координационное число 8). В соединениях проявляет степень окисления -2 (валентность II) и, реже, -1 (валентность I). По шкале Полинга электроотрицательность кислорода 3,5 (второе место среди неметаллов после фтора (см. ФТОР) ). В свободном виде кислород — газ без цвета, запаха и вкуса. История открытия История открытия кислорода, как и азота, связана с продолжавшимся несколько веков изучением атмосферного воздуха. О том, что воздух по своей природе не однороден, а включает части, одна из которых поддерживает горение и дыхание, а другая — нет, знали еще в 8 веке китайский алхимик Мао Хоа, а позднее в Европе — Леонардо да Винчи (см. ЛЕОНАРДО ДА ВИНЧИ). В 1665 английский естествоиспытатель Р. Гук (см. ГУК Роберт) писал, что воздух состоит из газа, содержащегося в селитре (см. СЕЛИТРЫ), а также из неактивного газа, составляющего большую часть воздуха. О том, что воздух содержит элемент, поддерживающий жизнь, в 18 веке было известно многим химикам. Шведский аптекарь и химик Карл Шееле (см. ШЕЕЛЕ Карл Вильгельм) начал изучать состав воздуха в 1768. В течение трех лет он разлагал нагреванием селитры (KNO3, NaNO3) и другие вещества и получал «огненный воздух», поддерживающий дыхание и горение. Но результаты своих опытов Шееле обнародовал только в 1777 году в книге «Химический трактат о воздухе и огне». В 1774 английский священник и натуралист Дж. Пристли (см. ПРИСТЛИ Джозеф) нагреванием «жженой ртути» (оксида ртути HgO) получил газ, поддерживающий горение. Будучи в Париже, Пристли, не знавший, что полученный им газ входит в состав воздуха, сообщил о своем открытии А. Лавуазье (см. ЛАВУАЗЬЕ Антуан Лоран) и другим ученым. К этому времени был открыт и азот. В 1775 Лавуазье пришел к выводу, что обычный воздух состоит из двух газов — газа, необходимого для дыхания и поддерживающего горение, и газа «противоположного характера» — азота. Лавуазье назвал поддерживающий горение газ oxygene — «образующий кислоты» (от греч. oxys — кислый и gennao — рождаю; отсюда и русское название «кислород»), так как он тогда считал, что все кислоты содержат кислород. Давно уже известно, что кислоты бывают как кислородсодержащими, так и бескислородными, но название, данное элементу Лавуазье, осталось неизменным. На протяжении почти полутора веков 1/16 часть массы атома кислорода служила единицей сравнения масс различных атомов между собой и использовалась при численной характеристике масс атомов различных элементов (так называемая кислородная шкала атомных масс). Нахождение в природе Кислород — самый распространенный на Земле элемент, на его долю (в составе различных соединений, главным образом силикатов (см. СИЛИКАТЫ)), приходится около 47,4% массы твердой земной коры. Морские и пресные воды содержат огромное количество связанного кислорода — 88,8% (по массе), в атмосфере содержание свободного кислорода составляет 20,95 % (по объему). Элемент кислород входит в состав более 1500 соединений земной коры. Получение В настоящее время кислород в промышленности получают за счет разделения воздуха при низких температурах. Сначала воздух сжимают компрессором, при этом воздух разогревается. Сжатому газу дают охладиться до комнатной температуры, а затем обеспечивают его свободное расширение. При расширении температура газа резко понижается. Охлажденный воздух, температура которого на несколько десятков градусов ниже температуры окружающей среды, вновь подвергают сжатию до 10—15 МПа. Затем снова отбирают выделившуюся теплоту. Через несколько циклов «сжатие—расширение» температура падает ниже температуры кипения и кислорода, и азота. Образуется жидкий воздух, который затем подвергают перегонке (дистилляции). Температура кипения кислорода (–182,9°C) более чем на 10 градусов выше, чем температура кипения азота (–195,8°C). Поэтому из жидкости азот испаряется первым, а в остатке накапливается кислород. За счет медленной (фракционной) дистилляции удается получить чистый кислород, в котором содержание примеси азота составляет менее 0,1 объемного процента. Еще более чистый кислород можно получить при электролизе водных растворов щелочей (NaOH или KOH) или солей кислородсодержащих кислот (обычно используют раствор сульфата натрия Na2SO4). В лаборатории небольшие количества не очень чистого кислорода можно получить при нагревании перманганата калия KMnO4: 2KMnO4 = K2MnO4 + MnO2 + O2. Более чистый кислород получают разложением пероксида водорода Н2О2 в присутствии каталитических количеств твердого диоксида марганца MnO2: 2Н2О2 = 2Н2О + О2. Кислород образуется при сильном (выше 600°C) прокаливании нитрата натрия NaNO3: 2NaNO3 =2NaNO2 + О2, при нагревании некоторых высших оксидов: 4CrO3= 2Cr2O3 + 3О2; 2PbO2 = 2PbO + О2; 3MnO2 = Mn3O4 + О2. Ранее кислород получали разложением бертолетовой соли (см. БЕРТОЛЕТОВА СОЛЬ) KClO3 в присутствии каталитических количеств диоксида марганца MnO2: 2KClO3 = 2KCl + 3О2. Однако бертолетова соль образует взрывчатые смеси, поэтому ее для получения кислорода в лабораториях теперь не используют. Разумеется, сейчас никому в голову не придет использовать для получения кислорода прокаливание оксида ртути HgO, так как образующийся в этой реакции кислород загрязнен ядовитыми парами ртути. Источником кислорода в космических кораблях, подводных лодках и т. п. замкнутых помещениях служит смесь пероксида натрия Na2O2 и супероксида калия KO2. При взаимодействии этих соединений с углекислым газом освобождается кислород: 2Na2O2 + 2CO2 = 2Na2CO3 + O2, 4КО2 + 2СО2 = 2К2СО3 + 3О2. Если использовать смесь Na2O2 и КО2, взятых в молярном отношении 1:1, то на каждый моль поглощенного из воздуха углекислого газа будет выделяться 1 моль кислорода, так что состав воздуха не будет изменяться за счет поглощения при дыхании кислорода и выделения СО2. Особенности строения молекулы О 2 Атмосферный кислород состоит из двухатомных молекул. Межатомное расстояние в молекуле О2 0,12074 нм. Молекулярный кислород (газообразный и жидкий) — парамагнитное вещество, в каждой молекуле О2 имеется по 2 неспаренных электрона. Этот факт можно объяснить тем, что в молекуле на каждой из двух разрыхляющих орбиталей находится по одному неспаренному электрону. Энергия диссоциации молекулы О2 на атомы довольно высока и составляет 493,57 кДж/моль. Физические и химические свойства При нормальных условиях плотность газа кислорода 1,42897 кг/м3. Температура кипения жидкого кислорода (жидкость имеет голубой цвет) –182,9°C. При температурах от –218,7°C до –229,4°C существует твердый кислород с кубической решеткой (a-модификация), при температурах от –229,4°C до –249,3°C — b-модификация с гексагональной решеткой и при температурах ниже –249,3°C — кубическая g-модификация. При повышенном давлении и низких температурах получены и другие модификации твердого кислорода. При 20°C растворимость газа О2: 3,1 мл на 100 мл воды, 22 мл на 100 мл этанола, 23,1 мл на 100 мл ацетона. Существуют органические фторсодержащие жидкости (например, перфторбутилтетрагидрофуран), в которых растворимость кислорода значительно более высокая. Высокая прочность химической связи между атомами в молекуле О2приводит к тому, что при комнатной температуре газообразный кислород химически довольно малоактивен. В природе он медленно вступает в превращения при процессах гниения. Кроме того, кислород при комнатной температуре способен реагировать с гемоглобином (см. ГЕМОГЛОБИН) крови (точнее с железом II гема (см. ГЕМ) ), что обеспечивает перенос кислорода от органов дыхания к другим органам. Со многими веществами кислород вступает во взаимодействие без нагревания, например, с щелочными и щелочноземельными металлами (образуются соответствующие оксиды типа Li2O, CaO и др., пероксиды типа Na2O2, BaO2 и др. и супероксиды типа КО2, RbO2 и др.), вызывает образование ржавчины на поверхности стальных изделий. Без нагревания кислород реагирует с белым фосфором, с некоторыми альдегидами и другими органическими веществами. При нагревании, даже небольшом, химическая активность кислорода резко возрастает. При поджигании он реагирует со взрывом с водородом, метаном, другими горючими газами, с большим числом простых и сложных веществ. Известно, что при нагревании в атмосфере кислорода или на воздухе многие простые и сложные вещества сгорают, причем образуются различные оксиды, например: S+O2 = SO2; С + O2 = СО24Fe + 3O2 = 2Fe2O3; 2Cu + O2 = 2CuO 4Nh4 + 3O2 = 2N2 + 6h3O; 2h3S + 3O2 = 2h3O + 2SO2Если смесь кислорода и водорода хранить в стеклянном сосуде при комнатной температуре, то экзотермическая реакция образования воды 2Н2 + О2= 2Н2О + 571 кДж протекает крайне медленно; по расчету, первые капельки воды должны появиться в сосуде примерно через миллион лет. Но при внесении в сосуд со смесью этих газов платины или палладия (играющих роль катализатора), а также при поджигании реакция протекает со взрывом. С азотом N2 кислород реагирует или при высокой температуре (около 1500—2000°C), или при пропускании через смесь азота и кислорода электрического разряда. При этих условиях обратимо образуется оксид азота (II): N2 + O2 = 2NO Возникший NO затем реагирует с кислородом с образованием бурого газа (диоксида азота): 2NO + О2 = 2NO2Из неметаллов кислород напрямую ни при каких условиях не взаимодействует с галогенами, из металлов — с благородными металлами серебром, золотом, платиной и др. Бинарные соединения кислорода, в которых степень окисления атомов кислорода равна –2, называют оксидами (см. ОКСИДЫ) (прежнее название — окислы). Примеры оксидов: оксид углерода (IV) CO2,оксид серы (VI) SO3, оксид меди (I) Cu2O, оксид алюминия Al2O3, оксид марганца (VII) Mn2O7. Кислород образует также соединения, в которых его степень окисления равна –1. Это — пероксиды (старое название — перекиси), например, пероксид водорода Н2О2, пероксид бария ВаО2, пероксид натрия Na2O2 и другие. В этих соединениях содержится пероксидная группировка — О — О —. С активными щелочными металлами, например, с калием, кислород может образовывать также супероксиды, например, КО2 (супероксид калия), RbO2 (супероксид рубидия). В супероксидах степень окисления кислорода –1/2. Можно отметить, что часто формулы супероксидов записывают как К2О4, Rb2O4 и т.д. С самым активным неметаллом фтором кислород образует соединения в положительных степенях окисления. Так, в соединении O2F2 степень окисления кислорода +1, а в соединении O2F — +2. Эти соединения принадлежат не к оксидам, а к фторидам. Фториды кислорода можно синтезировать только косвенным путем, например, действуя фтором F2 на разбавленные водные растворы КОН. Применение кислорода Применение кислорода очень разнообразно. Основные количества получаемого из воздуха кислорода используются в металлургии. Кислородное (а не воздушное) дутье в домнах позволяет существенно повышать скорость доменного процесса, экономить кокс и получать чугун лучшего качества. Кислородное дутье применяют в кислородных конвертерах при переделе чугуна в сталь (см. ст. Железо (см. ЖЕЛЕЗО)). Чистый кислород или воздух, обогащенный кислородом, используется при получении и многих других металлов (меди (см. МЕДЬ), никеля (см. НИКЕЛЬ), свинца (см. СВИНЕЦ) и др.). Кислород используют при резке и сварке металлов. При этом применяют «баллонный» кислород. В баллоне кислород может находиться под давлением до 15 МПа. Баллоны с кислородом окрашены в голубой цвет. Жидкий кислород — мощный окислитель, его используют как компонент ракетного топлива. Пропитанные жидким кислородом такие легко окисляющиеся материалы, как древесные опилки, вата, угольный порошок и др. (эти смеси называют оксиликвитами (см. ОКСИЛИКВИТЫ) ), используют как взрывчатые вещества, применяемые, например, при прокладке дорог в горах. Биологическая роль кислорода Кислород в атмосфере Земли начал накапливаться в результате деятельности первичных фотосинтезирующих организмов, появившихся, вероятно, около 2,8 млрд. лет назад. Полагают, что 2 млрд. лет назад атмосфера уже содержала около 1% кислорода; постепенно из восстановительной она превращалась в окислительную и примерно 400 млн. лет назад приобрела современный состав. Наличие в атмосфере кислорода в значительной степени определило характер биологической эволюции. Аэробный (с участием О2) обмен веществ возник позже анаэробного (без участия О2), но именно реакции биологического окисления, более эффективные, чем древние энергетические процессы брожения и гликолиза, снабжают живые организмы большей частью необходимой им энергии. Исключение составляют облигатные анаэробы, например, некоторые паразиты, для которых кислород является ядом. Использование кислорода, обладающего высоким окислительно-восстановительным потенциалом, в качестве конечного акцептора электронов в цепи дыхательных ферментов, привело к возникновению биохимического механизма дыхания современного типа. Этот механизм и обеспечивает энергией аэробные организмы. Кислород — основной биогенный элемент (см. БИОГЕННЫЕ ЭЛЕМЕНТЫ) , входящий в состав молекул всех важнейших веществ, обеспечивающих структуру и функции клеток — белков, нуклеиновых кислот, углеводов, липидов, а также множества низкомолекулярных соединений. В каждом растении или животном кислорода гораздо больше, чем любого другого элемента (в среднем около 70%). Мышечная ткань человека содержит 16% кислорода, костная ткань — 28.5%; всего в организме среднего человека (масса тела 70 кг) содержится 43 кг кислорода. В организм животных и человека кислород поступает в основном через органы дыхания (свободный кислород) и с водой (связанный кислород). Потребность организма в кислороде определяется уровнем (интенсивностью) обмена веществ, который зависит от массы и поверхности тела, возраста, пола, характера питания, внешних условий и др. В экологии как важную энергетическую характеристику определяют отношение суммарного дыхания (то есть суммарных окислительных процессов) сообщества организмов к его суммарной биомассе. Небольшие количества кислорода используют в медицине: кислородом (из так называемых кислородных подушек) дают некоторое время дышать больным, у которых затруднено дыхание. Нужно, однако, иметь в виду, что длительное вдыхание воздуха, обогащенного кислородом, опасно для здоровья человека. Высокие концентрации кислорода вызывают в тканях образование свободных радикалов, нарушающих структуру и функции биополимеров. Сходным действием на организм обладают и ионизирующие излучения. Поэтому понижение содержания кислорода (гипоксия) в тканях и клетках при облучении организма ионизирующей радиацией обладает защитным действием — так называемый кислородный эффект (см. КИСЛОРОДНЫЙ ЭФФЕКТ). Этот эффект используют в лучевой терапии: повышая содержание кислорода в опухоли и понижая его содержание в окружающих тканях усиливают лучевое поражение опухолевых клеток и уменьшают повреждение здоровых. При некоторых заболеваниях применяют насыщение организма кислородом под повышенным давлением — гипербарическую оксигенацию (см. ГИПЕРБАРИЧЕСКАЯ ОКСИГЕНАЦИЯ).dic.academic.ru
Кислород – характеристика элемента, распространённость в природе, физические и химические свойства, получение » HimEge.ru
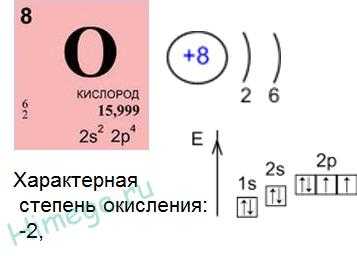 Кислород О имеет атомный номер 8, расположен в главной подгруппе (подгруппе а) VI группе, во втором периоде. В атомах кислорода валентные электроны размещаются на 2-м энергетическом уровне, имеющем только s— и p-орбитали. Это исключает возможность перехода атомов О в возбуждённое состояние, поэтому кислород во всех соединениях проявляет постоянную валентность, равную II. Имея высокую электроотрицательность, атомы кислорода всегда в соединениях заряжены отрицательно (с.о. = -2 или -1). Исключение – фториды OF2 и O2F2.
Кислород О имеет атомный номер 8, расположен в главной подгруппе (подгруппе а) VI группе, во втором периоде. В атомах кислорода валентные электроны размещаются на 2-м энергетическом уровне, имеющем только s— и p-орбитали. Это исключает возможность перехода атомов О в возбуждённое состояние, поэтому кислород во всех соединениях проявляет постоянную валентность, равную II. Имея высокую электроотрицательность, атомы кислорода всегда в соединениях заряжены отрицательно (с.о. = -2 или -1). Исключение – фториды OF2 и O2F2.
Для кислорода известны степени окисления -2, -1, +1, +2
Общая характеристика элемента
Кислород – самый распространенный элемент на Земле, на его долю приходится чуть меньше половины, 49 % от общей массы земной коры. Природный кислород состоит из 3 стабильных изотопов 16О, 17О и 18О (преобладает 16О). Кислород входит в состав атмосферы (20,9 % по объему, 23,2 по массе), в состав воды и более 1400 минералов: кремнезема, силикатов и алюмосиликатов, мраморов, базальтов, гематита и других минералов и горных пород. Кислород составляет 50-85% массы тканей растений и животных, т.к содержится в белках, жирах и углеводах, из которых состоят живые организмы. Общеизвестна роль кислорода для дыхания, для процессов окисления.
Кислород сравнительно мало растворим в воде – 5 объемов в 100 объемах воды. Однако, если бы весь растворенный в воде кислород перешел в атмосферу, то он занял бы огромный объем – 10 млн км3 ( н.у). Это равно примерно 1% всего кислорода в атмосфере. Образование на земле кислородной атмосферы обусловлено процессами фотосинтеза.
Открыт шведом К. Шееле ( 1771 – 1772 г.г) и англичанином Дж. Пристли ( 1774г.). Первый использовал нагревание селитры, второй – оксида ртути (+2). Название дал А.Лавуазье («оксигениум» — «рождающий кислоты»).
В свободном виде существует в двух аллотропных модификациях – «обыкновенного» кислорода О2 и озона О3.
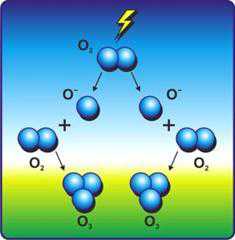
Строение молекулы озона
3О2 = 2О3 – 285 кДжОзон в стратосфере образует тонкий слой, который поглощает большую часть биологически вредного ультрафиолетового излучения.При хранении озон самопроизвольно превращается в кислород. Химически кислород О2 менее активен, чем озон. Электроотрицательность кислорода 3,5.
Физические свойства кислорода
O2 – газ без цвета, запаха и вкуса, т.пл. –218,7 °С, т.кип. –182,96 °С, парамагнитен.
Жидкий O2 голубого, твердый – синего цвета. O2 растворим в воде (лучше, чем азот и водород).
Получение кислорода
1. Промышленный способ — перегонка жидкого воздуха и электролиз воды:
2Н2О → 2Н2 + О2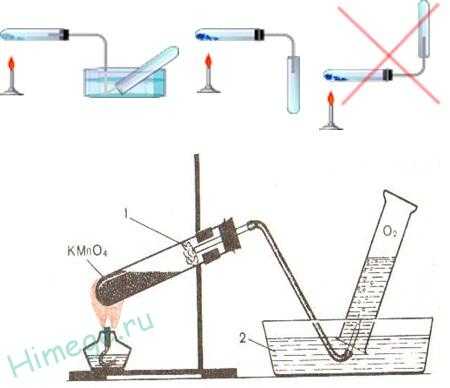
2. В лаборатории кислород получают:1.Электролизом щелочных водных растворов или водных растворов кислородосодержащих солей (Na2SO4 и др.)
2. Термическим разложением перманганата калия KMnO4:2KMnO4 = K2MnO4 + MnO2 + O2↑,
Бертолетовой соли KClO3:2KClO3 = 2KCl + 3O2↑ (катализатор MnO2)
Оксида марганца (+4) MnO2:4MnO2 = 2Mn2O3 + O2↑ (700 oC),
3MnO2 = 2Mn3O4 + O2↑ (1000 oC),
Пероксид бария BaO2 :2BaO2 = 2BaO + O2↑
3. Разложением пероксида водорода:2h3O2 = h3O + O2↑ (катализатор MnO2)
4. Разложение нитратов:2KNO3 → 2KNO2 + O2
На космических кораблях и подводных лодках кислород получают из смеси K2O2 и K2O4:2K2O4 + 2h3O = 4KOH +3O2↑4KOH + 2CO2 = 2K2CO3 + 2h3O
Суммарно:2K2O4 + 2CO2 = 2K2CO3 + 3О2 ↑
Когда используют K2O2, то суммарная реакция выглядит так:2K2O2 + 2CO2 = 2K2CO3 + O2 ↑
Если смешать K2O2 и K2O4 в равномолярных (т.е. эквимолярных) количествах, то на 1 моль поглощенного СО2 выделится один моль О2.
Химические свойства кислорода
Кислород поддерживает горение. Горение — быстрый процесс окисления вещества, сопровождающийся выделением большого количества теплоты и света. Чтобы доказать, что в склянке находится кислород, а не какой-то другой газ, надо в склянку опустить тлеющую лучинку. В кислороде тлеющая лучинка ярко вспыхивает. Горение различных веществ на воздухе – это окислительно-восстановительный процесс, в котором окислителем является кислород. Окислители – это вещества, «отбирающие» электроны у веществ-восстановителей. Хорошие окислительные свойства кислорода можно легко объяснить строением его внешней электронной оболочки.
Валентная оболочка кислорода расположена на 2-м уровне – относительно близко к ядру. Поэтому ядро сильно притягивает к себе электроны. На валентной оболочке кислорода 2s2 2p4 находится 6 электронов. Следовательно, до октета недостает двух электронов, которые кислород стремится принять с электронных оболочек других элементов, вступая с ними в реакции в качестве окислителя.
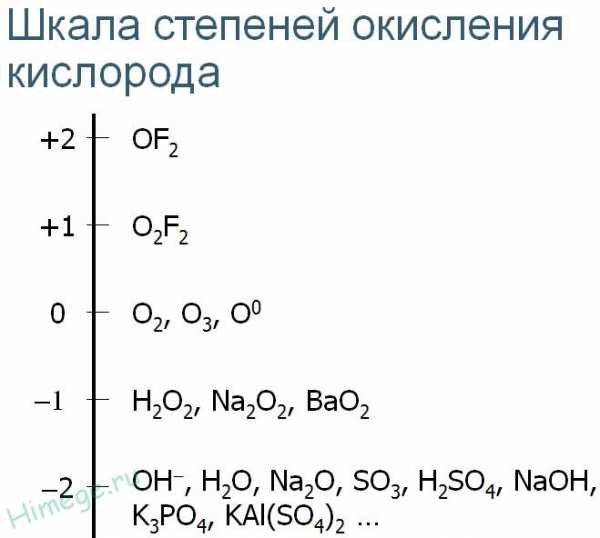 Кислород имеет вторую (после фтора) электроотрицательность в шкале Полинга. Поэтому в подавляющем большинстве своих соединений с другими элементами кислород имеет отрицательную степень окисления. Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления.
Кислород имеет вторую (после фтора) электроотрицательность в шкале Полинга. Поэтому в подавляющем большинстве своих соединений с другими элементами кислород имеет отрицательную степень окисления. Более сильным окислителем, чем кислород, является только его сосед по периоду – фтор. Поэтому соединения кислорода с фтором – единственные, где кислород имеет положительную степень окисления.
Итак, кислород – второй по силе окислитель среди всех элементов Периодической системы. С этим связано большинство его важнейших химических свойств.С кислородом реагируют все элементы, кроме Au, Pt, He, Ne и Ar, во всех реакциях (кроме взаимодействия со фтором) кислород — окислитель.
 Кислород легко реагирует с щелочными и щелочноземельными металлами:
Кислород легко реагирует с щелочными и щелочноземельными металлами:
4Li + O2 → 2Li2O,
2K + O2 → K2O2,
2Ca + O2 → 2CaO,
2Na + O2 → Na2O2,
2K + 2O2 → K2O4
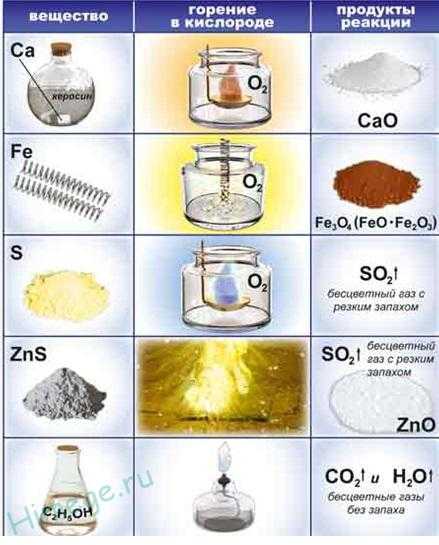
Мелкий порошок железа ( так называемого пирофорного железа) самовоспламеняется на воздухе, образуя Fe2O3, а стальная проволока горит в кислороде, если ее заранее раскалить:
3 Fe + 2O2 → Fe3O4
2Mg + O2 → 2MgO
2Cu + O2 → 2CuO
С неметаллами (серой, графитом, водородом, фосфором и др.) кислород реагирует при нагревании:
S + O2 → SO2,
C + O2 → CO2,
2h3 + O2 → h3O,
4P + 5O2 → 2P2O5,
Si + O2 → SiO2, и т.д
Почти все реакции с участием кислорода O2 экзотермичны, за редким исключением, например:
N2 + O2 → 2NO – Q
Эта реакция протекает при температуре выше 1200 oC или в электрическом разряде.
Кислород способен окислить сложные вещества, например:
2h3S + 3O2 → 2SO2 + 2h3O (избыток кислорода),
2h3S + O2 → 2S + 2h3O (недостаток кислорода),
4Nh4 + 3O2 → 2N2 + 6h3O (без катализатора),
4Nh4 + 5O2 → 4NO + 6h3O (в присутствии катализатора Pt ),
Ch5 (метан) + 2O2 → CO2 + 2h3O,
4FeS2 (пирит) + 11O2 → 2Fe2O3 + 8SO2.
Известны соединения, содержащие катион диоксигенила O2+, например, O2+ [PtF6]— (успешный синтез этого соединения побудил Н. Бартлетта попытаться получить соединения инертных газов).

Озон химически более активен, чем кислород O2. Так, озон окисляет иодид — ионы I— в растворе Kl:
O3 + 2Kl + h3O = I2 + O2 + 2KOH
Озон сильно ядовит, его ядовитые свойства сильнее, чем, например, у сероводорода. Однако в природе озон, содержащийся в высоких слоях атмосферы, выполняет роль защитника всего живого на Земле от губительного ультрафиолетового излучения солнца. Тонкий озоновый слой поглощает это излучение, и оно не достигает поверхности Земли. Наблюдаются значительные колебания в толщине и протяженности этого слоя с течением времени (так называемые озоновые дыры) причины таких колебаний пока не выяснены.
Применение кислорода O2: для интенсификации процессов получения чугуна и стали, при выплавке цветных металлов, как окислитель в различных химических производствах, для жизнеобеспечения на подводных кораблях, как окислитель ракетного топлива (жидкий кислород), в медицине, при сварке и резке металлов.
Применение озона О3: для обеззараживания питьевой воды, сточных вод, воздуха, для отбеливания тканей.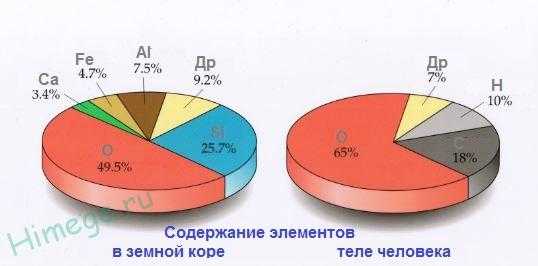
Биологическая роль р-элементов VIA группы. Применение их соединений в медицине
himege.ru










